Draslík – jeden z nejdůležitějších prvků nezbytných pro udržení života rostlin a zvířat. Je nedílnou součástí hnojiv, která se používají v zemědělství pro zvýšení produktivity a kvality půdy. Velké zásoby draslíku se nacházejí v útrobách Země a těží se speciálními metodami.
Jednou z hlavních metod získávání draslíku je těžba draselné soli. V přirozeném stavu se draslík obvykle vyskytuje ve formě halitu, minerálu, ze kterého se získává převážná část draselné soli. K těžbě draselné soli se používají různé metody, včetně vrtání studní, rozřezávání hornin, rozbíjení a zpracování materiálu. Vytěžená draselná sůl je následně podrobena speciálnímu zpracování, aby se získal finální produkt – hnojivo nebo surovina pro chemický průmysl.
Další důležitou metodou pro získání draslíku je použití spalování síranů. Sírany draselné najdeme v přírodě ve formě minerálů jako je bluestone, medicinální kalinit a další. Draslík se získává ze síranů jejich spalováním a následným zpracováním výsledných produktů. Tato metoda je zvláště aktivně používána v chemickém průmyslu.
Draslík je jedním z nejdůležitějších makroprvků nezbytných pro normální vývoj rostlin. Proto jsou způsoby jeho těžby a výroby důležité pro zemědělství a průmysl.
Extrakce draslíku je tedy složitý a mnohostranný proces, včetně různých výrobních metod. Draselná sůl a sírany draselné jsou hlavními produkty tohoto procesu a jsou široce používány v zemědělství, chemickém průmyslu a dalších odvětvích hospodářství. Bez nich by obrovské plochy půdy se sterilními a vyčerpanými minerály byly pro zemědělství zcela nevhodné. Proto těžba a produkce draslíku hraje v moderním světě důležitou roli.
Metody získávání draslíku ze země
Další metodou pro extrakci draslíku je rozpouštění draselných solí v podzemních otevřených slojích. Pro tento proces se vyvrtá otvor, kterým se podzemní voda přivádí pod vysokým tlakem do vrstev s draselnými solemi. V důsledku toho se soli rozpustí a výsledný roztok s draslíkem se extrahuje na povrch. Poté se roztok podrobí speciálnímu zpracování, aby se získal draslík jako hotový produkt.
Třetí metodou je povrchová těžba draslíku. V tomto případě se draslík získává z mělkých ložisek pomocí speciálního vrtného zařízení. Poté draslík, který je ve formě solí, prochází procesem obohacení a oddělení od nečistot. Výsledný draslík se používá v různých průmyslových odvětvích a zemědělství.
Jak se získává draslík z oceánských vod
Před zahájením procesu je oceánská voda nejprve přefiltrována, aby se odstranily velké nečistoty a kontaminanty. Poté se provádí dehydratace solí, kdy se pomocí různých metod, jako je odpařování, zářivky a zlaté uzení, přeměňuje slaná voda na soli, které obsahují draslík.
Dále kapalina prochází elektrolyzéry, kde je aplikováno konstantní elektrické napětí, takže kationty draslíku jsou přitahovány k elektrodě a ukládány na ní. Výsledkem tohoto procesu je výroba čistého draslíku ve formě kovových ingotů.
Extrahovaný draslík je pak čištěn a přetvářen za vzniku různých forem, jako jsou potašová hnojiva a chemické sloučeniny, které jsou široce používány v zemědělství a dalších průmyslových odvětvích.
Průmyslová výroba draslíku z okurek
Průmyslová výroba draslíku ze solí probíhá v několika fázích. Nejprve dochází k těžbě soli, která může být podzemní nebo otevřená. Soli pak procházejí procesem čištění k odstranění nečistot, který zahrnuje flotaci, třídění a další metody. Poté se soli převedou do rozpuštěného stavu přidáním vody a filtrací.
Vyčištěný solný roztok prochází procesem elektrolýzy, jehož výsledkem je štěpení molekul na draselné ionty. Draselné ionty se ukládají na zápornou elektrodu ve formě kovového draslíku. Tento produkt prochází dalším čištěním a zpracováním, po kterém může být použit v zemědělství nebo jiných průmyslových odvětvích.
Je důležité si uvědomit, že výroba draslíku ze solí je poměrně složitý a energeticky náročný proces. Touto metodou však lze získat vysoce kvalitní draslík, který je nezbytný pro zásobování rostlin nezbytnými živinami.
| Etapy výroby draslíku ze solí |
|---|
| Těžba soli |
| Čištění solí od nečistot |
| Rozpouštění solí ve vodě a filtrace |
| Elektrolýza |
| Čištění a zpracování výsledného produktu |
Nové technologie těžby a výroby draslíku
Jedním z příkladů nové technologie je metoda extrakce draslíku rozpuštěním rudy ve vodě. Tato metoda se nazývá hydrotermální úprava. Umožňuje extrahovat draslík z minerálních solí obsažených v rudě, bez potřeby chemických činidel.
Další novinkou v oblasti těžby draslíku je metoda flotačního obohacování. Je založena na použití speciálních činidel, která umožňují selekci a sběr draselné soli, přičemž zbývající složky rudy zůstávají v odpadních materiálech.
Nové technologie se využívají i při výrobě potašových hnojiv. Jedním z nich je proces granulace, při kterém se draselné soli lisují pod vysokým tlakem a mění se na granule vhodného tvaru.
Další novinkou je proces s uzavřenou smyčkou, který minimalizuje emise a recykluje odpad z výroby. Tato metoda umožňuje extrahovat a zpracovávat draslík způsobem šetrným k životnímu prostředí.
Použití nových technologií pro těžbu a výrobu draslíku může snížit dopad na životní prostředí, zlepšit kvalitu produktů a snížit výrobní náklady. Díky tomu se draslík stává dostupnější a využívá se v mnoha průmyslových odvětvích a zemědělství.
Environmentální aspekty těžby draslíku
Při průzkumu a vývoji ložisek potaše se provádějí různé inženýrské práce, včetně vrtání studní a stavebních štol. To může vést ke změnám hydrogeologické situace, ale i poklesu hladin podzemních vod. Tyto procesy mohou ovlivnit ekosystémy a zemědělskou půdu v okolních oblastech.
Moderní technologie těžby draslíku však mohou snížit dopad na životní prostředí. Používá se například metoda zpětného zaplavení, která umožňuje obnovit hladinu podzemní vody po těžbě a minimalizovat vliv na hydrogeologickou situaci.
K zamezení znečištění vodních zdrojů se používají různé systémy zpracování a likvidace odpadu. Provádí se také monitorování kvality vody, aby se rychle odhalily a vyřešily problémy se znečištěním. Společnosti zabývající se těžbou draslíku jsou povinny dodržovat všechny ekologické předpisy a normy.
Těžební společnosti navíc aktivně pracují na snižování emisí skleníkových plynů a využívají technologie šetřící energii. To pomáhá minimalizovat dopad na klimatický systém planety.
Moderní technologie tedy i přes některá environmentální rizika spojená s těžbou draslíku umožňují minimalizovat negativní dopady na životní prostředí a ekosystémy. Společnosti zabývající se těžbou draslíku aktivně pracují na bezpečnosti životního prostředí a dodržování všech nezbytných norem a standardů.
Lidský mozek se neustále učí. Nezáleží na tom, co děláme a jaké konkrétní akce den za dnem opakujeme. K pevnému upevnění návyku je nutné neustálé opakování a mozek se určitě naučí nové věci, dokonce podstoupí změny ve svém fyzickém těle. Kdysi dávno vědci začali poznávat náš svět. Vytvořili vztahy příčina-následek a byli překvapeni, když objevili nové přírodní zákony. Jedním z úkolů pro vědce tedy byla záhada prvku draslíku – chemického prvku, který je důležitý pro živé bytosti.
- Historie objevu
- Draslík v přírodě
- Způsoby, jak se dostat
- Fyzikální vlastnosti
- Chemické vlastnosti
- Rozsah aplikace

Historie objevu
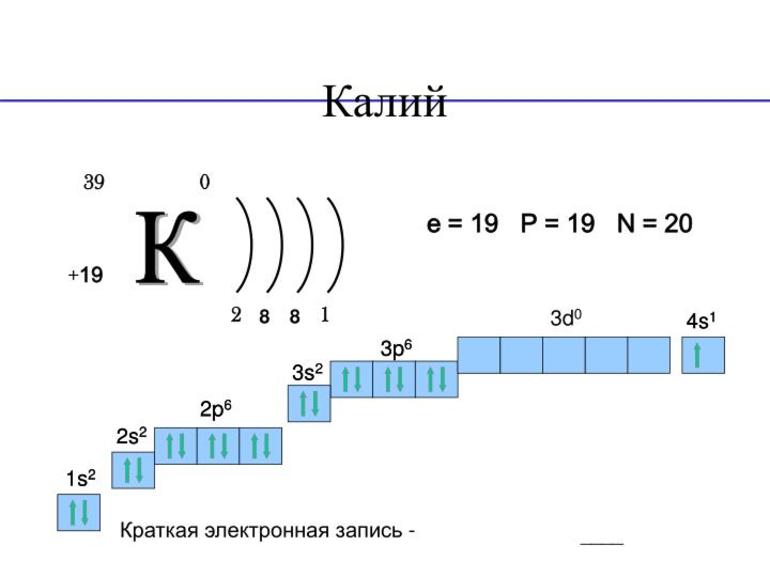
Atomové číslo draslíku 19, který udává jeho umístění v periodické chemické tabulce.
Přibližná molární hmotnost 39,1 g/mol.
Elektronová konfigurace draslíku 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1

Jediný možný oxidační stav je +1 (plus jedna).
Ve vnější energetické hladině je pouze 1 elektron. To znamená, že maximální valence prvku je 1.
Krystalová mřížka jednoduché látky je krychlová, na tělo centrovaná.
V roce 1807 anglický chemik H. Davy experimentálně získal draslík (latinský název – draslík). Tak se draslík původně jmenoval. Při provádění elektrolýzy žíravé vody a taveniny potaše si vědec všiml vzniku měkkého, tavitelného kovu. Tento úspěch ho posunul k novým objevům a začal studovat chemické a fyzikální vlastnosti nové látky.
Taková senzace šokovala celý vědecký svět a zahraniční kolegové se rozhodli nezůstat stranou. Jen o 2 roky později navrhl britský expert L.V. Gilbert název „Al-Kali“, což v překladu z arabštiny znamená „rostlinný popel“. A to není překvapivé, protože popel, který zůstal po spálení rostlin, byl ošetřen vodou a výsledná směs byla odpařena do sucha. V dávných dobách se používal jako prací prostředek. V roce 1831 německý fyzik G.I. Hess, který studoval vlastnosti nové látky, navrhl své jméno pro prvek, který se také nazýval „Al-draslík“.
Draslík v přírodě

Po mnoha letech hledání se ukázalo, že draslík se v přírodě v čisté formě nenachází. Je to jeden z deseti prvků, které tvoří většinu světa kolem nás.
Draslík je nedílnou součástí buněk živých organismů. Ve velkém množství se vyskytuje také v minerálech a mořské vodě. Minerály, jejichž složení se může pochlubit vysokým obsahem tohoto prvku:
- Silvinit KCl·NaCl.
- Carnallite KCl MgCl2 6H2.
- Cainite KCl MgS4 6H2.
- Rostlinný popel jako potaš K 2 CO 3.
Způsoby, jak se dostat
Moderní podmínky vědcům umožňují získat draslík několika způsoby.
Rovnice pro interakci s kapalným sodíkem roztavené báze při 380-450 °C nebo chloridem při 760-890 °C: Na + KOH = NaOH + K
Elektrolýza roztaveného chloridu smíchaného s uhličitanem draselným při teplotě asi 700 °C:
Fyzikální vlastnosti
Nízkotavitelný stříbrný kov. Při řezání rychle vytvoří oxidový film po několika sekundách kontaktu s kyslíkem, což vysvětluje požadavky na speciální vnitřní podmínky. Skladujte pouze v nádobách s petrolejem, silikony nebo benzínem. Má dobrou rozpustnost v kombinaci se rtutí. Tvoří amalgámy.
Ve spojení s vodou reaguje výbuchem. Při dotyku hořáku se plamen změní na růžovofialový.
Chemické vlastnosti
Draslík má mnoho společného se sodíkem. To je způsobeno jejich umístěním v periodické tabulce chemických prvků od D. I. Mendělejeva. Oba prvky jsou alkalické kovy, které jasně vyjadřují jejich vlastnosti. Draslík má však kovové vlastnosti, které jsou silnější než vlastnosti sodíku a vápníku, ale slabší než vlastnosti rubidia.
Draslík má tendenci vykazovat takové vlastnosti, které jej činí nepostradatelným pro chemický průmysl:
- Chemicky aktivní.
- Snadno se vzdává elektronů.
- Silné redukční činidlo.
Oxidy nebo peroxidy
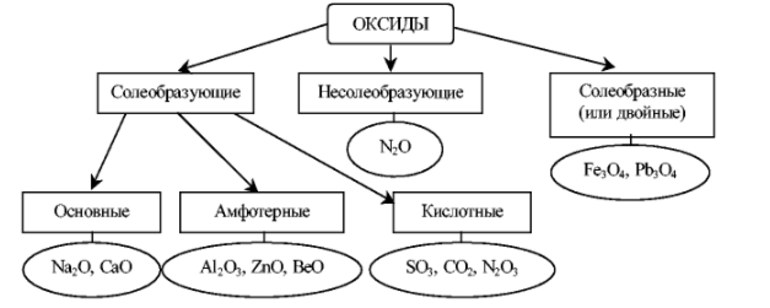
Při interakci s kyslíkem nevytváří oxid, ale peroxid nebo superoxid, což je patrné pouhým okem (velmi rychle vytváří na povrchu oxidový film).
Může tvořit oxid pouze při pomalém zahřívání na teploty pod 180 °C v prostředí s nízkým obsahem kyslíku.
Oxidy jasně vykazují základní vlastnosti. Stejně jako samotný kov prudce reagují s vodou, oxidy kyselin a samotnými kyselinami. V průmyslu nenašly praktické uplatnění, používají se pro výuku na vysokých školách.
Peroxidy jsou bílé prášky se žlutým odstínem. Dobře se rozpouštějí ve vodě, tvoří alkálie a peroxid vodíku.
Silná oxidační činidla, proto si získaly oblibu v textilním průmyslu jako bělicí činidlo.
Hydroxidy draselné
Hydroxid draselný a sodný mají zvláštní názvy: hydroxid draselný a hydroxid sodný. Bílé, pevné, neprůhledné látky. Jsou velmi hygroskopické, což znamená, že rychle absorbují vlhkost a vyžadují zvláštní pozornost při práci s nimi. Laborant musí nosit rukavice a ochranné brýle, jinak dostane těžké popáleniny a podráždění sliznic. Krystaly tají při teplotě 360 °C. Hydroxidy jsou klasifikovány jako alkálie, rychle se rozpouštějí ve vodě a uvolňují velké množství tepla.
Rozsah aplikace

Sloučeniny draslíku se používají jako hnojiva, což svědčí o jeho cenných biologických vlastnostech. Jedna z nejdůležitějších složek biosystému spolu s dusíkem a fosforem. Kromě toho je nezbytná výměna prvku v sodno-draselné pumpě buňky jakéhokoli živého organismu.
Získal velkou popularitu v galvanickém pokovování. Soli kovů se ve srovnání se sodnými solemi rozpouštějí rychle. Tato vlastnost umožňuje společnostem zpracovávajícím draslík stanovit vysoké ceny.
Kapalná slitina draslíku a sodíku se používá jako chladivo v jaderných elektrárnách. Požadovaný stav: pokojová teplota.
Speciální sloučeniny draslíku

Bromid se používá ve farmacii k výrobě sedativ.
Mezi zahradníky jsou oblíbené uhličitany, chloridy a dusičnany, neboť jde o hnojiva obohacená o velké množství užitečných mikroprvků.
Manganistan se používá v chemických laboratořích k výrobě kyslíku a dříve byl také široce používán v každodenním životě díky svým antiseptickým vlastnostem.
Peroxid a superoxid zajišťují regeneraci vzduchu v ponorkách a plynových maskách díky své schopnosti absorbovat oxid uhličitý a uvolňovat kyslík.

Z popisu vlastností draslíku s dalšími prvky je zřejmé, že se jedná o nesmírně důležitou složku organismu, která musí interagovat s jinými kovy i nekovy, aby zajistila harmonický růst a vývoj organismu. Norma spotřeby tohoto prvku pro člověka je 2040 mg denně.
Úloha tohoto kovu a tělesné reakce, kterých se účastní, jsou velmi důležité pro stavbu buněk, které tvoří jakýkoli živý organismus. Díky tvorbě různých chemických vazeb pomohl draslík lidstvu dosáhnout nových výšin ve stavbě lodí, zahradnictví a farmaceutickém průmyslu.
Jeho všudypřítomná přítomnost v přírodě umožňuje kontinuálně těžit kov a jeho sloučeniny a díky pokrokům vědců v oblasti chemie je možné regulovat hustotu obsahu draslíku v přípravcích. Pokud jsou dodrženy správné proporce a jsou navrženy algoritmy, lze předvídat výhody nebo škody.
Draslík může být užitečný, ale také může lidi odsoudit k těžkému utrpení, jako jsou popáleniny rukou, podráždění sliznic. To by si měl zapamatovat každý, kdo se chce dozvědět více o vlastnostech tohoto kovu. Než začnete pracovat s nebezpečnými látkami, je lepší se naučit vše o mnohaletých zkušenostech vašich předchůdců, abyste se vyhnuli smutným a nevratným následkům.




